本文來源:中國中藥雜志, 2017年17期 :補體抑制活性物質魚腥草總多糖中內毒素的去除,如需刪除請留意,謝謝。
[關鍵詞]
魚腥草總多糖、內毒素、顯色法基質鱟試劑盒、廈門鱟試劑、 抗補體、 疏水色譜、親和吸附色譜
[背景]
魚腥草Houttuynia Herba為三白草科Saururaceae蕺菜屬植物蕺菜Houttuynia cordata Thunb.的新鮮全草和干燥的地上部分,具有利尿通淋、抗炎抗過敏、增強機體免疫力等功效[13]。補體系統(complement system)是將對病原體的識別有效地轉化為宿主對最初感染發揮防御功能的主要機制之一。補體的過度激活會引起人體免疫系統的過度反應,參與多種疾病的病理過程[4],臨床上目前尚無理想的治療藥物。近年來,本課題組致力于中藥補體抑制劑的研究,分離得到了一些高效、低毒的小分子化合物及大分子多糖類天然補體抑制劑[58]。其中,魚腥草總多糖抗補體活性較強[9],同時具有顯著的解熱和防治內毒素(lipopolysaccharides,LPS)誘導的急性肺損傷藥效[1011],臨床開發應用前景良好。
[摘要]
本實驗通過柱色譜聯用去除魚腥草總多糖中的LPS,以顯色基質比色法定量檢測內毒素含量,比較疏水色譜與親和吸附色譜的聯用及凝膠過濾色譜與親和吸附色譜的聯用對LPS的清除率,同時比較LPS清除前后魚腥草總多糖體外補體抑制活性的變化,為中藥活性多糖藥物中LPS的去除提供方法參考。
以下為部分實驗內容分享,如需閱讀全文請與我司業務員聯系。
1 材料
魚腥草,經鑒定為三白草科Saururaceae 蕺菜屬植物蕺菜H. cordata的干燥地上部分。魚腥草總多糖為采用課題組前期優化工藝自制[9]。endprint
LPS對照品(Pharmacia Biotech);顯色基質法鱟試劑盒;透析袋。氯化鈉、磷酸二氫鈉、磷酸氫二鈉、硫酸及苯酚均為國產AR級,苯酚用前重熏。
廈門鱟試劑生物科技股份有限公司顯色基質鱟試劑盒
電子天平,TDL4型低速臺式離心機,Well scan MK3型酶標儀,EYELAOSB2100型旋轉蒸發儀,精達水浴恒溫振蕩器,RLPHR 12 LD型冷凍干燥器,UV759S 紫外可見分光光度計,HL2S型橫流泵,BSZ100型自動部分收集儀。
2 方法
2.1 顯色基質法[21]定量檢測LPS含量
2.1.1 反應試劑的配制 按標示量加細菌內毒素檢查用水溶解鱟試劑,鱟試劑應于溶解后10 min內使用。按標示量加內毒素檢查用水溶解顯色基質。按標示量加反應終止劑HCl配制偶氮化試劑1。按標示量加內毒素檢查用水溶解偶氮化試劑2,3。
2.1.2 對照品及待測樣品溶液的配制 精密稱取適量對照品,用細菌內毒素檢查用水配制成濃度分別為0.01, 0.025, 0.05, 0.1 EU·mL-1或0.1, 0.25, 0.5, 1.0 EU·mL-1。精密稱取適量待測樣品,加內毒素檢查用水配制成待測樣品溶液。
2.1.3 陰性對照品溶液的配制 取100 μL內毒素標準溶液及100 μL待測樣品溶液,加入100 μL細菌內毒素檢查用水,混勻,即為陰性對照品溶液。
2.1.4 內毒素含量測定方法 取300 μL對照品,加入鱟試劑100 μL,混勻,根據其內毒素濃度范圍分別于37 ℃溫浴45 min或8 min后,加入顯色基質溶液100 μL,混勻,37 ℃溫浴6 min,繼續加入偶氮化試劑1、偶氮化試劑2和偶氮化試劑3溶液各500 μL,混勻靜置5 min,于545 nm下測定其吸光度。
以吸光度值為縱坐標,內毒素濃度為橫坐標,建立標準曲線,求回歸方程。
陰性對照品溶液或待測樣品溶液的內毒素濃度測量法同上。
2.1.5 供試品干擾實驗 由于要考察試驗中各因素對鱟試劑、標準品或待測樣品反應的影響,故需進行供試品干擾實驗,計算回收率。回收率計算方式如下:
R=(Cs-Ct)/Cr×100%
Cr:選取靠近內毒素標準曲線中點的濃度;Cs:配制含有內毒素濃度為Cr的供試品溶液,其測量所得的內毒素濃度值記為Cs;Ct:未添加內毒素的供試品所測得的內毒素濃度值。
當R在50%~200%時,認為此實驗條件下對供試品溶液不存在干擾。若R超出此范圍則需進一步對供試品進行稀釋,重復供試品干擾實驗至R進入50%~200%。一般選擇R接近100%時的供試品濃度進行供試品的內毒素含量測定。

3 結果
3.1 內毒素標準品回歸方程的建立
當LPS濃度范圍為0.01~0.1 EU·mL-1時,回歸方程為Y=0.872 9X-0.040 9,R2=0.992 8;LPS濃度范圍為0.1~1.0 EU·mL-1時,回歸方程為Y=6.183 1X-0.002 5,R2=0.995 3。
3.2 魚腥草總多糖中內毒素的去除
3.2.1 凝膠過濾色譜法與親和吸附色譜法聯用 將魚腥草總多糖經Sephacryl S300柱洗脫后的洗脫液6~10管合并、透析、凍干,記為H1;將H1樣品再次經AffiPrep Polymyxin柱純化,其洗脫液的3~5管合并、透析、凍干,記為H1′, 見圖1。
3.2.2 疏水色譜法與親和吸附色譜法聯用 將魚腥草總多糖經Penyl Sepharose 6 FF柱洗脫后的洗脫液6~13管合并、透析、凍干,記為H2;將H2樣品經AffiPrep Polymyxin柱洗脫后的3~5管合并、透析、凍干,記為H2′,見圖2。
3.3 供試品干擾實驗
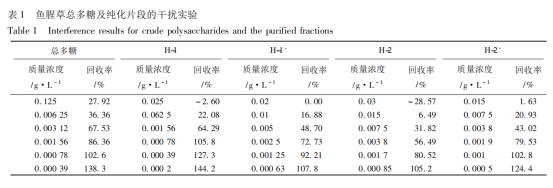
為避免試驗中各因素對鱟試劑、標準品或待測樣品反應的影響,對供試品進行了干擾實驗,計算回收率,并選擇回收率接近100%時的供試品濃度進行供試品的內毒素含量測定。魚腥草總多糖的質量濃度達到0.000 79 g·L-1時,回收率為接近100%;H1的質量濃度達到0.000 78 g·L-1時,回收率為接近100%;H1′的質量濃度達到0.001 25 g·L-1時,回收率為接近100%;H2的質量濃度達到0.000 85 g·L-1時,回收率為接近100%;H2′的質量濃度達到0.001 g·L-1時,回收率為接近100%,見表1。
3.4 內毒素的含量測定與抗補體活性測定
取魚腥草總多糖及3.2項不同程度純化樣品H1, H1′, H2, H2′,根據干擾實驗結果,分別配置回收率接近100%的各樣品溶液,以2.4項所述方法測定其內毒素含量;取上述各樣品按2.5項方法測定抗補體活性CH50。魚腥草總多糖不同方法純化前后的內毒素含量及抗補體活性變化結果見表2。
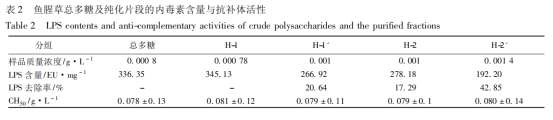
LPS去除率=(總多糖LPS量-純化片段LPS量)/總多糖LPS量×100%

